多发性骨髓瘤:全球首款BCMA靶点 CAR-T细胞药物上市
文章来源:卡森细胞 发布时间:2021-04-01
2021年03月27日,百时美施贵宝(BMS)与合作伙伴蓝鸟生物(Bluebrid Bio)联合宣布,美国食品和药物管理局(FDA)已批准Abecma(idecabtagene vicleucel,ide-cel),该药是一种B细胞成熟抗原(anti-BCMA)导向的嵌合抗原受体(CAR)T细胞疗法,用于治疗复发性/难治性多发性骨髓瘤(R/R MM)。
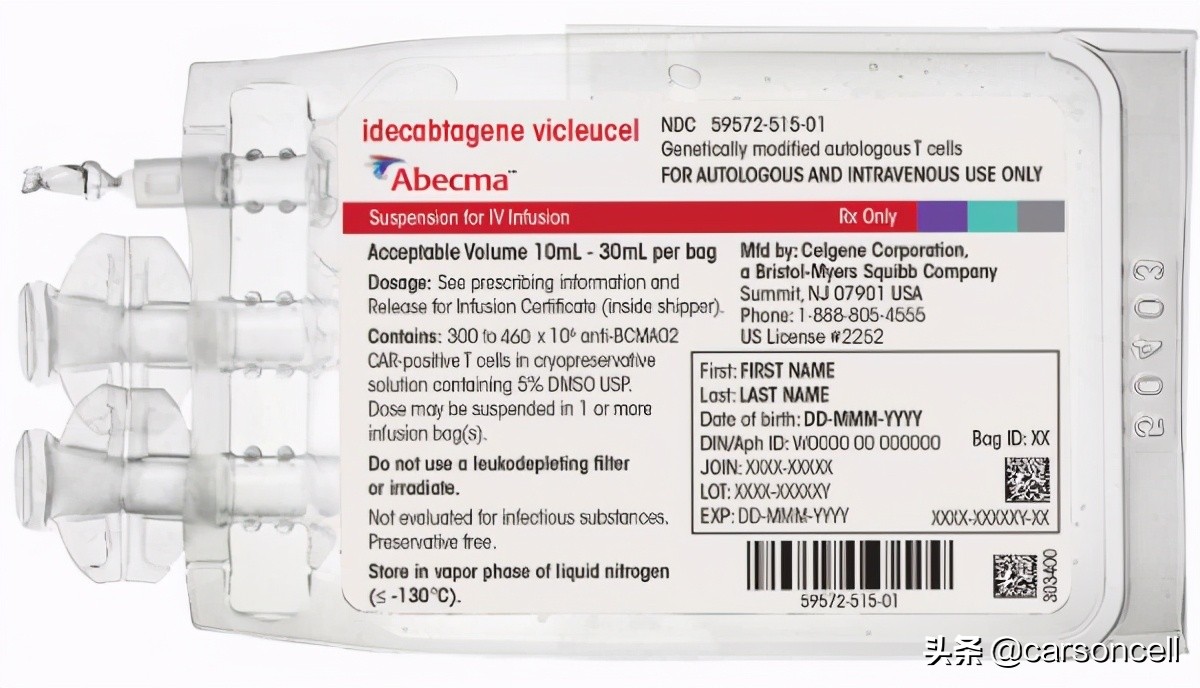
至此,全球首个靶向BCMA的CAR-T细胞疗法上市,也是迄今为止获批的第五款CAR-T细胞疗法。
近年来,肿瘤免疫治疗在肿瘤治疗中发挥的作用日益受到重视,而作为肿瘤免疫治疗重要组成部分的过继性细胞治疗,因其可在短时间内扩增和活化具有抗肿瘤活性的效应细胞,治疗副作用轻微等优点在临床中备受关注。但肿瘤抗原特异性强、亲和力好的免疫细胞来源困难、数量较少,以及杀瘤活性、体内持续时间未能达到临床应用的需求。研究者尝试使用基因修饰T细胞来解决这个问题。CAR基因修饰的T细胞(简称CAR-T细胞)在这种背景下应运而生。
嵌合抗原受体-CAR 的发展
随着科学技术研究的持续推进,CARs至今已经发展到了第四代。
|
发展 |
特点 |
|
|
第一代 |
结构 |
包含胞外单链可变片段scFv、跨膜区和单个胞内激活信号 CD3ζ或FcεRIγ |
|
缺点 |
第一代CAR-T细胞只能引起短暂的 T 细胞增殖和较少的细胞因子分泌,其体内抗肿瘤活性受到极大限制,T 细胞增殖减少最终导致 T 细胞的凋亡 |
|
|
第二代 |
优化 |
在一代基础上引入了一个共刺激分子,提高了肿瘤杀伤效力; |
|
第三代 |
结构 |
搭载了多个共刺激因子,如CD28、CD134(OX40)和CD137 (4-1BB)等,可以激活T细胞内的JNK、ERK、NF-κB等信号通路 |
|
优势 |
在延长 T 细胞抗肿瘤活性、增殖活性、存活周期及细胞因子(如 IL-2、TNF-α 和 IFN-γ)的分泌等方面均有显著提高; |
|
|
第四代 |
优化 |
在第三代的基础上增加了可选择性的标记及编码 CARs 扩增、自杀的启动子。 |
诺华公司与2017年8月获批全球第一个CRA-T疗法治疗急性B细胞型淋巴性白血病后,该技术路线成为近年来治疗血液性肿瘤的最前沿方向,是唯一可以根治肿瘤性疾病的方法。
Abecma同前四款CAR-T技术一样,也是一款自体免疫细胞疗法,治疗中使用的T细胞来自于患者。该技术突破点在于靶点不同和适应症不同:前4款CAR-T细胞疗法的靶点为CD19,而Abecma靶点为BCMA;Abecma适应症为多发性骨髓瘤,而前四款为急性白血病和淋巴瘤。
CD19是当今研究中最常见的靶向抗原,CD19-CAR-T有显著的治疗白血病的疗效,并有相关的药物上市。Liu等[1](2017)对中国已备案的CAR-T临床研究(Clinical Trials.gov)进行的统计中发现在121项临床研究(目前中国已有相关备案241项)中57项是把CD19作为靶标来治疗白血病和B细胞淋巴瘤,还有一项是治疗系统性红斑狼疮。另有19项是靶向抗原CD20、CD22、CD30、 CD33、CD38、CD123、CD138、BCMA和 Lewis Y来治疗恶性血液疾病。
多发性骨髓瘤治疗
多发性骨髓瘤是一种罕见的血液瘤。患者的骨髓无法产生足够的健康血细胞,导致血液细胞数降低。骨髓瘤还会损害患者骨骼和肾脏,影响免疫力,多发性骨髓瘤常伴有多发性溶骨性损害、高钙血症、贫血、肾脏损害。由于正常免疫球蛋白的生成受抑,因此容易出现各种细菌性感染。发病率估计为2~3/10万,男女比例为1.6:1,大多患者年龄>40岁。。据美国国家癌症研究所(National Cancer Institute)数据显示,2020年骨髓瘤约占美国所有新癌症病例的1.8%。这款免疫细胞药物的上市,无疑为多发性骨髓瘤患者的治疗康复打开了一扇新的门。
截止今年3月,全球5款CAR-T细胞疗法上市。诺华Kymriah比较于吉利德Yescarta上市早,但定价高,疗效无优势,整体销售使用状况不如Yescarta。2019年,诺华Kymriah销售额为2.78亿美元,在2020年达到4.74亿美元。与此同时,吉利德Yescarta在2020年在细胞疗法领域销售额增长33%,达到6.07亿美元。
CAR-T的研究现状与发展趋势
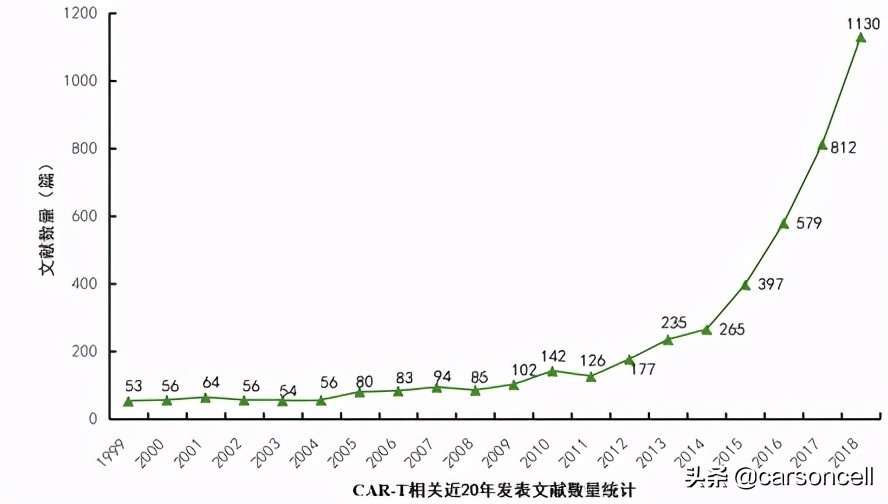
从近20年WOS数据库有关CAR-T发表的文献数量来看,近五年来显现明显的上升趋势,充分体现了CAR-T在当今科学研究的热潮。从发表文献的国家来看,美国在近20多年来总发表文献数量为2598篇,位居世界第一,中国尽管排在第二,但数量只有611篇。文章主要被发表在Blood(IF=16.5)和Molecular Therapy(IF=8.4)等知名学术期刊上。
2018年诺贝尔生理或医学奖颁给了德克萨斯大学的研究者詹姆斯·艾利森(James P.Allison)教授和日本京都大学的本庶佑(Tasuku Honjo)教授已表彰他们因发现抑制负向免疫调节的新型癌症疗法。
PD-1和CTLA-4是T细胞表面的特殊蛋白,阻断它们的表达对于抵御癌症的发展有重要作用。越来越多的研究者也开始把PD-1和CTLA-4结合CAR-T开发治疗癌症的药物或疗


